初回審査時の手続き
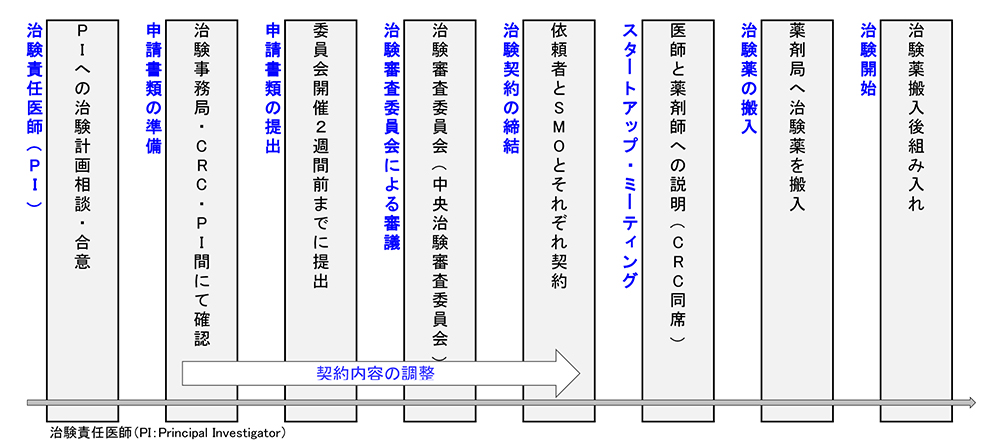
治験実施までの流れ
担当窓口について
| 業務内容 | 担当窓口 |
|---|---|
| 治験の申し込み、各種書類の送付、治験実施中の窓口 *書式18(開発の中止等に関する報告)を含む |
臨床試験管理センター治験事務局 |
| 治験契約の手続き、治験料(別表1)の請求 契約及び請求状況の管理 |
臨床試験管理センター施設契約担当 |
| 治験事務局の運用、CRC業務 | 株式会社アイロムOM |
| 診療費(別表2)の請求 *お問い合わせは「ソラスト治験担当」まで |
株式会社ソラスト |
| 閲覧用ICカードの発行及び費用を含む全体的な管理 *お問い合わせは「総務課ICカード担当」まで |
企業団事務局総務課 |
| 治験終了後(外部倉庫を含む)の記録の管理 | 薬剤局長(責任者)、薬剤局DI室 臨床試験管理センター施設契約担当 |
(備考)施設契約担当が不在の場合は「薬剤局DI室」までお問い合わせください。
書類送付先
〒781-8555 高知市池2125-1 高知医療センター 臨床試験管理センター 治験事務局お問い合わせ
代表番号:088-837-3000を通してご連絡ください。【お願い】
依頼者の担当者が交代したときは、必ず施設契約担当までご連絡ください。
治験申込時の提出書類について
実施医療機関の長に、「高知県・高知市病院企業団立高知医療センター病院長」と明記し、治験依頼書(書式3)1部、及び下記の審議用資料21部 (別途保管分3部を含む)を提出してください。
| 1 | 治験実施計画書 | ■治験実施計画書(又は製造販売後臨床試験実施要綱) ■別紙 ■その他 |
|---|---|---|
| 2 | 症例報告書 | □症例報告書の見本 ※治験実施計画書において、症例報告書に記載すべき事項が十分に読み取れる場合は不要 ■その他原資料として取り扱うもの(患者日誌、服薬手帳、アンケート用紙等) |
| 3 | 同意説明文書及びその他の説明文書※ | ■同意説明文書 □補助説明資料(治験・疾患に対する情報提供) ■補助説明資料(健康被害時の補償制度に関する資料) ■その他説明資料 |
| 4 | 被験者の募集手順に関する資料※ | 【新聞広告等】 ■新聞広告(案) ■募集手順の概要 ■その他資料(コールセンタースクリプト等) 【院内掲示・配布】 ■ポスター(案) ■リーフレット |
| 5 | 治験薬概要書 | ■治験薬概要書(又は添付文書) ■概要書追補・補遺 |
| 6 | 被験者の安全等に係わる報告 | ■治験薬概要書に未記載の副作用報告等 ■その他安全性情報等 |
| 7 | 被験者への支払いに関する資料※ | ■1来院あたり支払う費用 ■期間を通じ予定される負担軽減費の合計金額 |
| 8 | 健康被害に対する補償に関する資料 ※ | ■生産物賠償責任保険等写しまたは付保証明書等 ■治験依頼者の補償制度の概要に関する説明資料 |
| 9 | 治験責任医師及び分担医師となるべきものの氏名を記載した文書 | 提出済みの履歴書(写) 分担医師リスト(雛形あり) |
| 10 | その他 | ■治験参加カード※ ■治験依頼書(書式3)※ |
※印の書類は提出前に内容を一度確認しますので、治験事務局まで提出してください。また、定期的に治験に関する情報(会議の記録の概要や治験実施一覧など)をHPに掲載していますので、新規申請の書類確認の際、依頼者に関する情報について確認します。
申請に係る注意事項について
| 初回審査資料の提出期限について | 「電子媒体案はIRB申請4週間前まで」、「FIXした電子媒体または紙媒体はIRB申請2週間前まで」、に治験事務局まで提出してください。なお、提出期限に間に合わない場合は治験事務局まで相談してください。 |
| 治験審査委員会当日について | 当日の説明は、原則、治験依頼者に説明をお願いします。担当CRCより来院時間等の詳細についてご案内します。なお初回以外の審査時のときは、必要時に説明をお願いする場合があります。 |
| 治験審査委員会当日の説明用資料について | 薬剤の概要及び試験の概略は、パワーポイント資料にて作成し、初回審議資料の冒頭に差し込んでください。なお、医学知識を有さない委員が理解できるように、専門用語には脚注や用語解説を添付してください。 |
| 説明する内容について | 下記の内容を同意説明文書の内容と順序にリンクするような形で資料を準備してください。 ・開発の経緯(市場の状況、開発の意義) ・治験薬の概要(作用機序、効果、安全性面を中心など) ・本プロトコールの内容(選択・除外基準の概要と治験スケジュールなど) |
| 説明する時間について | 10~15分程度でお願いします。 |
| 継続申請時の手続きについて | 実施医療機関の長は「高知県・高知市病院企業団立高知医療センター病院長」と明記してください。継続審査資料の提出部数及び提出先は初回審査時と同様です。ご不明な点は治験事務局までご連絡ください。 ・治験依頼書(書式3)1部 ・審議用資料21部 (別途保管分3部を含む) |
| 安全性情報の資料について | 原則、本審査となります。投与終了後などに本審査不要で保管対応のみで対応できる場合は、治験事務局までご連絡ください。また、IRBの審議が必要となりますので、安全性情報等に関する報告書(書式16)及びラインリストに加え、詳細資料(症例票)を提出してください。一方、PIの見解確認方法については、最初にCRCを通して確認してください。 |
標準業務手順書(SOP)
標準作業手順書(SOP:Standard Operating Procedures)は、治験の際に必ず守るべき基本的な業務手順をまとめたもので、治験が均質に遂行されることを目的に、治験に関わる製薬企業、医薬品開発業務受託機関 (CRO:Contract Research Organization)、医療機関によって作られています。当施設では一部の書式について押印を省略していますので、詳細は標準業務手順書第22条を参照してください。
